Nguyên tử là đơn vị chức năng cấu hình cơ bạn dạng nhất xuất hiện vào cụ thể từng dạng vật hóa học. Nguyên tử cần thiết như thế tuy nhiên ko cần người nào cũng biết vấn đề về bọn chúng. Bởi vậy tuy nhiên VUIHOC tiếp tục ghi chép nội dung bài viết này nhằm mục đích canh ty những em thăm dò hiểu về cấu hình vẹn toàn tử và cỗ bài xích tập dượt tự động luyện tương quan cho tới phần kỹ năng và kiến thức này.
1. Nguyên tử là gì?
Nguyên tử là một trong đơn vị chức năng cơ bạn dạng của vật hóa học, bao gồm những phân tử siêu nhỏ và hòa hợp về năng lượng điện. Nguyên tử với có một phân tử nhân ở trung tâm và được đám mây năng lượng điện âm electron bảo phủ.
Bạn đang xem: Đầy đủ lý thuyết và bài tập về cấu trúc nguyên tử - Hoá học 10 VUIHOC

Những vẹn toàn tử thông thường đem độ dài rộng siêu nhỏ, 2 lần bán kính chỉ tầm vài ba phần mươi của nano mét. Nguyên tử được kí hiệu là Z (Zahl bám theo giờ đồng hồ Đức)
2. Thành phần cấu hình vẹn toàn tử
2.1. Lớp vỏ electron
Electron là những phân tử đem năng lượng điện âm (-), bọn chúng vận động xung xung quanh phân tử nhân tạo hình lớp vỏ electron của nguyeent tử.
Electron được kí hiệu là e.
Khối lượng của electron là: mạ = 9,1094.10-31 kg
Điện tích của electron bằng: qe = -1,602.10-19 C (culông)
Điện tích của electron sẽ tiến hành kí hiệu là – eo và được quy ước bởi vì 1-.
Vỏ của từng vẹn toàn tử thì sẽ sở hữu được một hoặc nhiều tầng electron và từng lớp tiếp tục chứa chấp số lectron chắc chắn. Trong đó:
- Lớp electron nhập nằm trong, ngay sát phân tử nhân luôn luôn với 2 electron.
- Các lớp sót lại thì sẽ sở hữu được tối đa là 8 electron.
Ví dụ: Nguyên tử oxi với chứa chấp 8 electron và được tạo thành 2 lớp. Trong số đó, lớp loại nhất với 2 electron và lớp loại nhì với 6 electron.
2.2. Hạt nhân vẹn toàn tử
Phía nhập lớp vỏ của vẹn toàn tử là phần phân tử nhân. Các mái ấm vật lý cơ học tập tiếp tục mày mò rời khỏi rằng: phân tử nhân của vẹn toàn tử chứa chấp những loại phân tử là proton (mang năng lượng điện dương) và nơtron ko đem năng lượng điện.
| |
Proton
|
Nơtron
|
|
Kí hiệu
|
p
|
n
|
|
Khối lượng
|
1,6726.10-27 (kg)
|
1,6748.10-27 (kg)
|
|
Điện tích
|
+ 1,602.10-19 C (culông)
|
|
i) Số proton là đặc thù cho tới từng loại nhân tố. Còn những vẹn toàn tử với số proton tương đương nhau tuy nhiên lại không giống nhau về con số neutron thì bọn chúng sẽ tiến hành gọi là những đồng vị không giống nhau của một nhân tố.
Ví dụ: cacbon-12(p=6,n=6), carbon-13(p=6,n=7) và cacbon-14(p=6,n=8) là tía đồng vị của nhân tố cacbon
ii) Nguyên tử hòa hợp và năng lượng điện, hoặc tức là nhập một vẹn toàn tử thì số proton tiếp tục thông qua số electron.
Ví dụ: Nguyên tử Oxi với 8 proton (+) nhập nhân và 8 electron (-) vận động ở lớp vỏ vẹn toàn tử.
iii) Lưu ý: proton và nơtron với lượng ngay sát đều nhau, còn electron thì rất rất nhẹ nhõm đối với nhì loại phân tử này. Vì vậy cho nên lượng của vẹn toàn tử được xấp xỉ bởi vì lượng của phân tử nhân.
3. Mô hình cấu hình vẹn toàn tử
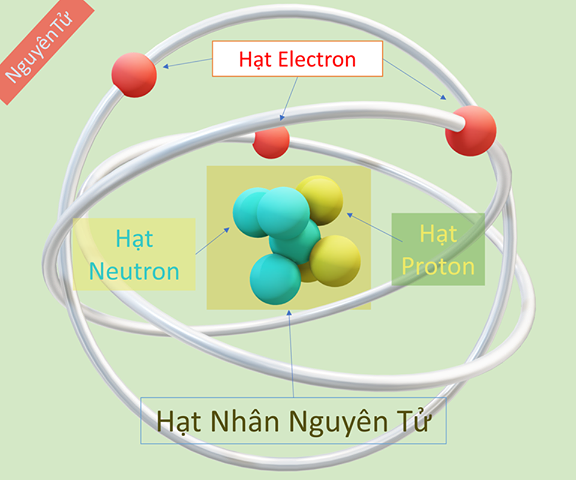
Sơ thiết bị kết cấu vẹn toàn tử tiếp tục chứa chấp lớp vỏ tương tự lớp phân tử nhân và được nối cùng nhau bởi vì những phân tử và bọn chúng đem năng lượng điện cùng theo với những phân tử ko đem năng lượng điện. Có phân tử nhận e và cúng với phân tử nhường nhịn e tạo thành một sự links vẹn toàn tử khá vững chãi.
4. Kích thước và lượng của kết cấu vẹn toàn tử
4.1. Kích thước của vẹn toàn tử
Kích thước khi đầu sẽ tiến hành đo dựa vào đơn vị chức năng nanomet (nm) hoặc angstrom (Å):
-
1 nm = 10-9 m
-
1 Å = 10-10 m
Nguyên tử H được nghe biết là vẹn toàn tử nhỏ nhất và nửa đường kính của chính nó tiếp tục rơi vào tầm khoảng 0,053 nm.
Đối với phân tử nhân, hoàn toàn có thể 2 lần bán kính chỉ rơi vào tầm khoảng 10-5 nm, còn 2 lần bán kính của p và e thì chỉ ở mức 10-8 nm.
4.2. Khối lượng của vẹn toàn tử
Hạt nhân là đối tượng người sử dụng đa số canh ty đo KL của vẹn toàn tử. Vậy nên KL của vẹn toàn tử còn được gọi là KL của phân tử nhân cùng theo với đv được xem kí hiệu là u (đvC)
Giá trị của 1u(đvC) =1/12 KL của một vẹn toàn tử C.
Trong đó: KL vẹn toàn tử C tiếp tục = 19,9265.10-27kg => 1u = 19,9265.10-27kg /12 = 1,6605.10-27kg
5. Phân lớp e nhập kết cấu vẹn toàn tử
5.1. Lớp e là gì?
Trong kết cấu vẹn toàn tử, lớp e là thuật ngữ nhằm chỉ những e với những nấc tích điện gần như là nhau và trật tự bố trí của bọn chúng tiếp tục tăng dần dần lên kể từ nấc tích điện thấp cho tới một nấc tích điện cao nào là ê và phân trở nên 7 lớp.
|
Mức tích điện n
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Tên lớp
|
K
|
L
|
M
|
N
|
O
|
P
|
Q
|

5.2. Phân lớp e
Có 4 phân lớp được phân chia kể từ những lớp e ê là s, p, d, f và bao gồm những e với nấc tích điện đều nhau.
|
Phân lớp
|
s
|
p
|
d
|
f
|
|
Số e tối đa
|
2
|
6
|
10
|
14
|
|
Ký hiệu
|
s2
|
p6
|
d10
|
f14
|
6. Phân biệt phân tử và vẹn toàn tử
|
Đặc điểm
|
Nguyên tử
|
Phân tử
|
|
Khái niệm
|
Nguyên tử là phân tử rất rất nhỏ và cần thiết hòa hợp về năng lượng điện. Nguyên tử bao hàm phân tử nhân đem năng lượng điện (+) và vỏ tạo ra bởi vì một hoặc nhiều e đem năng lượng điện âm (-)
|
Phân tử là phân tử canh ty thay mặt đại diện cho tới hóa học, bao hàm một số trong những vẹn toàn tử links cùng nhau và thể hiện nay được rất đầy đủ đặc thù chất hóa học của chất
|
|
Ví dụ
|
Nguyên tử O, vẹn toàn tử C
|
O2, H2O
|
|
Hình dạng
|
Mang hình cầu
|
Có nhiều hình dáng
|
|
Tính chất
|
Không với kỹ năng phân song vẹn toàn tử
|
Các nhân tố nhập phân tử với kỹ năng tách tách và phối kết hợp lại với nhau
|
|
Sự tồn tại
|
Có thể tồn bên trên cũng hoàn toàn có thể ko tồn bên trên ở tình trạng tự động do
|
Thường tồn bên trên ở tình trạng tự động do
|
|
Tầm nhìn
|
Không thể nhìn được bởi vì đôi mắt thường
|
Không thể nhìn được bởi vì đôi mắt thông thường tuy nhiên hoàn toàn có thể để ý được bên dưới kính hiển vi
|
|
Khả năng phản ứng
|
Phản ứng mạnh (có nước ngoài lệ)
|
Phản ứng yếu ớt và ít
|
|
Liên kết
|
Liên kết ở phân tử nhân
|
Liên kết nằm trong hóa trị, links nằm trong ion
|
7. Luyện tập dượt cấu hình vẹn toàn tử: Bài tập dượt tự động luận và trắc nghiệm Hoá học tập 10
7.1. Bài tập dượt tự động luận SGK cơ bạn dạng và nâng cao
Câu 1:
a) Lớp và phân lớp electron là gì? Nêu cơ hội phân biệt lớp và phân lớp electron?
b) Tại sao lớp N hoàn toàn có thể chứa chấp cho tới 32 electron.
Lời giải:
a) Lớp electron: Trong vẹn toàn tử, những electron được xếp bám theo từng lớp, những lớp được xếp kể từ ngay sát phân tử nhân rồi ra bên ngoài dần dần. Các electron ở và một lớp sẽ sở hữu được tích điện gần như là nhau.
Các lớp bám theo trật tự được kí hiệu bởi vì những số vẹn toàn từ là 1 cho tới 7
Phân lớp electron: Mỗi lớp electron bao hàm những phân lớp với kí hiệu là những vần âm ghi chép thường: s, p, d, f.
Xem thêm: Màn chiếu
Phân biệt lớp và phân lớp: electron bên trên một tấm tiếp tục đem tích điện gần như là nhau còn với những electron nằm trong phân lớp thì với tích điện như nhau.
b) Lớp N với kỹ năng chứa chấp tối nhiều 32e là vì lớp này bao gồm những phân lớp: 4s, 4p, 4d, và 4f. Số e ứng hoàn toàn có thể có: phân lớp s với 2; p với 6; d với 10; f với 14 ⇒ cũng có thể với tối nhiều 32e
Câu 2: $_{40}^{18}\textrm{Ar}$ là kí hiệu của vẹn toàn tử Agon
a) Hãy cho thấy số proton, số nơtron bên phía trong phân tử nhân và số electron phía ngoài vỏ electron của vẹn toàn tử.
b) Nêu sự phân bổ electron phía trên những lớp.
Lời giải:
a) Ta thấy:
Z = con số p = con số e
A = con số p + con số n
Từ kí hiệu bên trên hoàn toàn có thể thấy thấy vẹn toàn tử Ar với Z=18; bởi vậy Ar sẽ sở hữu được 18p, 18e và có: 40 - 18 = 22 n
b) Lớp vỏ e của vẹn toàn tử bên trên được phân bổ như bên dưới đây:
$1s^2 2s^2 2p^6 3s^2 3p^6$.
Câu 3: Ytri (kí hiệu là Y) được nghe biết là làm công việc vật tư siêu dẫn với số khối là 89. Dựa bám theo bảng tuần trả, hãy cho thấy số p, số n và số e với nhập vẹn toàn tử của nhân tố Y.
Lời giải:
Theo bảng tuần trả thì tớ thấy ZY=39.
Từ đề bài xích tớ có: AY = 88 ⇔ số N= A−Z = 88−39 =49.
Vậy p = 39, e = 39 và n = 49.
Câu 4: sành KL của một vẹn toàn tử O nặng trĩu vội vàng 15,842 phen và KL của vẹn toàn tử C nặng trĩu vội vàng 11,906 phen KL của vẹn toàn tử H. Vậy nếu như tất cả chúng ta lựa chọn đơn vị chức năng là 1/12 lượng vẹn toàn tử C thì KL vẹn toàn tử của H, O là bao nhiêu?
Lời giải:
Ta thấy KL của một vẹn toàn tử C là 12u
Dựa đề bài xích tớ có:
$MC=11,906.MH$⇒$MH=\frac{12}{11906}=1,008u$
$MO=15,842.MH=15,842.1,008=15,969u$
Câu 5: Nguyên tố s, p, d, f là gì?
Lời giải:
Những nhân tố với vẹn toàn tử với e sau cuối được điền nhập phân lớp s được gọi là nhân tố s.
Những nhân tố với vẹn toàn tử với e sau cuối được điền nhập phân lớp s được gọi là nhân tố p.
Những nhân tố với vẹn toàn tử với e sau cuối được điền nhập phân lớp s được gọi là nhân tố d.
Những nhân tố với vẹn toàn tử với e sau cuối được điền nhập phân lớp s được gọi là nhân tố f.
Câu 6: Mô mô tả cấu hình không khí của phân tử adn?
Lời giải:

7.2. Sở thắc mắc trắc nghiệm rèn luyện Cấu trúc vẹn toàn tử
Câu 1: Có từng nào loại phân tử cơ bạn dạng kết cấu nên vẹn toàn tử?
A. 4 B. 2 C.3 D.1
Câu 2: Hạt đem năng lượng điện nhập vẹn toàn tử là:
A. e B. e, n
C. p, n D. e, p
Câu 3: Hầu không còn những vẹn toàn tử với loại phân tử nào là sau kết cấu nên phân tử nhân?
A. e, p, n B. e, n
C. p. n D. e, p
Câu 4: Hãy chỉ ra rằng xác định sai bên dưới đây?
A. Các phân tử proton, electron, nơtron là những bộ phận kết cấu của phân tử nhân vẹn toàn tử.
B. Trong vẹn toàn tử số p = số electron.
C. Số khối A là tổng p (Z) với tổng n (N).
D. Các phân tử proton, electron, nơtron kết cấu nên vẹn toàn tử.
Câu 5: Hãy chỉ ra rằng xác định sai bên dưới đây?
A. Số khối đó là tổng số phân tử p và n
B. Tổng số p + số e đó là số khối
C. Trong 1 vẹn toàn tử số p = số e và đó là năng lượng điện phân tử nhân
D. Số p = số e
Câu 6: #_{27}^{12}\textrm{Al}# là vẹn toàn tử có:
A. 13e, 14n, 13p. B. 14e, 14n, 13p.
C. 14e, 13n, 13p. D. 14e, 13n, 14p.
Câu 7: Trong phân tử nhân vẹn toàn tử $_{39}^{19}\textrm{K}$ có phân tử đem năng lượng điện là:
A. e B. p C. n D. Cả A, B
Câu 8: Hãy chỉ ra rằng xác định sai bên dưới đây?
A. Các loại phân tử cơ bản: proton, notron, electron kết cấu nên vẹn toàn tử.
B. Hạt nhân và lớp vỏ electron là bộ phận kết cấu của vẹn toàn tử .
C. Điện tích phân tử nhân = số proton + số electron ở nhập vẹn toàn tử.
D. Số khối A = số proton + số notron ở nhập vẹn toàn tử.
Câu 9: Electron thông thường được nhìn thấy nhập vẹn toàn tử hidro:
A. Tại phân tử nhân vẹn toàn tử
B. Không ở phân tử nhân tuy nhiên ở ngay sát phân tử nhân vì thế e bị bú mớm nhập bởi vì phân tử p.
C. Phía ngoài phân tử nhân và không ở gần đối với phân tử nhân
D. Tại vùng không khí xung xung quanh của phân tử nhân, vì thế e với kỹ năng được nhìn thấy ở từng điểm nhập vẹn toàn tử.
Câu 10: Số phân tử với nhập vẹn toàn tử của một nhân tố X là 34. Trong số ê phân tử đem năng lượng điện > phân tử ko đem năng lượng điện là 10. X là:
A. F B. Na C. K D. Al
Câu 11: Hãy chỉ ra rằng xác định sai bên dưới đây?
A. Số hiệu vẹn toàn tử = năng lượng điện phân tử nhân vẹn toàn tử.
B. Trong vẹn toàn tử, số p = số n.
C. Số p nhập phân tử nhân = số e ở lớp vỏ vẹn toàn tử.
D. Số khối của phân tử nhân vẹn toàn tử = tổng số phân tử p và số phân tử n.
Câu 12: Hạt đem năng lượng điện nhập vẹn toàn tử là
A. e. B. e, n.
C. p, n. D. p, e.
Câu 13: Trong vẹn toàn tử của nhân tố X sẽ sở hữu được tổng số phân tử cơ bản là 114, nhập ê số phân tử đem năng lượng điện > số phân tử ko đem năng lượng điện là 26. Nguyên tố X là
A. Br. B. Cl. C. Zn. D. Ag.
Câu 14: Nguyên tử X với tổng số phân tử cơ bạn dạng là 40. Trong số đó tổng số phân tử đem năng lượng điện > số phân tử ko đem năng lượng điện là 12 phân tử. Lớp ngoài nằm trong của vẹn toàn tử X với thông số kỹ thuật e là
A. $[Ne]3s^1$ B. $[Ne] 3s^2 3p^1$ C. $[Ne] 3s^2 3p^3$ D. $[Ne] 3s^2 3p^4$
Câu 15: Trong M2+ với tổng số phân tử cơ bạn dạng là 90, nhập số ê, phân tử đem năng lượng điện > số phân tử ko đem năng lượng điện là 22. M là nhân tố nào?
A. Cl. B. Cu. C. Ni. D. Zn.
Câu 16: Cation M3+ với chứa chấp 18 electron. Nguyên tố M với thông số kỹ thuật e là :
A. 1s^2 2s^2 2p^6 3s^2 3p^6 3d^1 4s^2. B. 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^1.
C. 1s^2 2s^2 2p^6 3s^2 3p^6 3d^2 4s^1. D. 1s^2 2s^2 2p^6 3s^2 3p^6 4s^1 3d^2.
Câu 17: Cho những tuyên bố bên dưới đây:
(1) Có 3 loại phân tử cơ bạn dạng kết cấu nên vẹn toàn tử.
(2) Hạt nhân nằm tại vị trí thân thiết vẹn toàn tử, bao gồm những phân tử p và n.
(3) Nguyên tử hòa hợp về năng lượng điện => số proton = số notron.
(4) Vỏ vẹn toàn tử chứa chấp những e vận động nhập không khí ở xung quanh phân tử nhân
(5) Số khối A của vẹn toàn tử = tổng của số proton + số electron.
(6) Số đơn vị chức năng năng lượng điện phân tử nhân chủ yếu thông qua số e.
Có bao nhiêu tuyên bố đích là:
A. 3 B. 4 C. 2 D.6
Câu 18: Trong vẹn toàn tử K với số n là:
A.19 B. 20 C.39 D.48
Câu 19: Fe với Z = 26. Cấu hình e nào là bên dưới đấy là của ion Fe2+?
A. $1s^2 2s^2 2p^6 3s^2 3p^6 3d^6 4s^2$
B. $1s^2 2s^2 2p^6 3s^2 3p^6 3d^6$
C. $1s^2 2s^2 2p^6 3s^2 3p^6 3d^5$
D. $1s^2 2s^2 2p^6 3s^2 3p^6 3d^4 4s^2$
Câu 20: Để links nghiêm ngặt nhất với phân tử nhân thì e nằm trong lớp nào là bên dưới đây?
Xem thêm: Môn Văn 8 - Tìm đáp án, giải bài tập, để học tốt
A. Lớp N B. Lớp L C. Lớp M D. Lớp K
Bảng đáp án tham lam khảo:
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| C |
D |
C |
A |
B |
A |
B |
C |
B |
B |
| 11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
| B |
D |
A |
B |
B |
A |
B |
B |
B |
D |
Muốn học tập về những thích hợp hóa học nhập hoá học tập thì trước không còn những em nên thăm dò hiểu kể từ những cấu hình cơ bạn dạng như vẹn toàn tử. sành được vai trò của vẹn toàn tử, VUIHOC tiếp tục ghi chép nội dung bài viết này nhằm mục đích gia tăng lý thuyết về cấu hình vẹn toàn tử kèm cặp cỗ bài xích tập dượt rất rất có ích. Để học tập tăng được rất nhiều những kỹ năng và kiến thức hoặc và thú vị về Hoá học tập 10 tương tự Hoá học tập trung học phổ thông thì những em hãy truy vấn khoayduoc.edu.vn hoặc ĐK khoá học tập với những thầy cô VUIHOC tức thì giờ đây nhé!